Prinsip Ekuipartisi Energi
Pada subbab A, Anda telah mempelajari hubungan antara variabel-variabel yang menyatakan keadaan suatu gas dalam ruangan tertutup. Untuk mengamati keadaan gas tersebut, dapat dilakukan dengan dua cara, yaitu cara makroskopis dan mikroskopis. Jika Anda mengamati keadaan suatu gas dalam ruang tertutup berdasarkan besaran-besaran yang dapat dilihat atau diukur secara langsung, Anda dikatakan melakukan pengamatan secara makroskopis. Namun, jika pengamatan yang Anda lakukan berdasarkan pada variabel atau besaran yang tidak dapat dilihat atau diukur secara langsung, Anda dikatakan melakukan pengamatan secara mikroskopis.
Pengamatan keadaan gas secara makroskopis telah Anda lakukan dan pelajari pada subbab A. Pada subbab B ini, Anda akan mempelajari keadaan gas yang diamati secara mikroskopis serta hubungan antara besaran makroskopis dan besaran mikroskopis.
1. Tinjauan Tekanan Secara Mikroskopis
Berdasarkan sifat-sifat gas ideal, Anda telah mengetahui bahwa setiap dinding ruang tempat gas berada, mendapat tekanan dari tumbukan partikel-partikel gas yang tersebar merata di dalam ruang tersebut. Cobalah Anda amati gerak satu partikel yang berada di dalam ruang berbentuk kubus dengan panjang rusuk kubus L. Massa partikel tersebut adalah m dan kecepatan partikel menurut arah sumbu-x dinyatakan sebagai vx (perhatikan Gambar 7).
 |
| Gambar 6. Sebuah partikel bergerak dengan kecepatan vx dalam ruang berbentuk kubus berusuk L. |
Jika partikel gas ideal tersebut menumbuk dinding ruang, tumbukan yang terjadi adalah tumbukan lenting sempurna. Oleh karena itu, jika kecepatan awal partikel saat menumbuk dinding A adalah +vx, kecepatan akhir partikel setelah terjadinya tumbukan dinyatakan sebagai - vx. Perubahan momentum (Dpx) yang dialami partikel adalah Dpx = pakhir – pawal = -mvx - (mvx) = -2mvx.
Setelah menumbuk dinding A, partikel gas ideal tersebut menumbuk dinding B. Demikian seterusnya, partikel gas tersebut akan bergerak bolak-balik menumbuk dinding A dan dinding B. Dengan demikian, Anda dapat menghitung selang waktu antara dua tumbukan yang terjadi pada dinding A dengan persamaan :
Dt = 2L / vx (1–15)
Pada saat partikel gas tersebut menumbuk dinding, partikel memberikan gaya sebesar Fx pada dinding. Pada pelajaran mengenai momentum, Anda telah mempelajari bahwa besarnya gaya yang terjadi pada peristiwa tumbukan sama dengan laju perubahan momentumnya (F = Dp / Dt). Dengan demikian, besar gaya Fx tersebut dapat diketahui sebagai berikut.
Fx = mvx2 / L (1–16)
Jika di dalam ruang berbentuk kubus tersebut terdapat sejumlah N partikel gas, yang kecepatan rata-rata seluruh molekul gas tersebut dinyatakan dengan vx, gaya yang dialami dinding dinyatakan sebagai Ftotal. Dengan demikian, Persamaan (1–16) dapat dinyatakan menjadi :
Anda dapat mencari besarnya tekanan (p) yang dilakukan oleh gaya total (Ftotal) yang dihasilkan oleh N partikel gas ideal tersebut pada dinding A.
p = Ftotal / A
Oleh karena luas dinding adalah perkalian antara dua panjang rusuk dinding tersebtu (A = L2 maka persamaan tekanan pada dinding dapat ditulis dengan :
atau ;
pV = Nmvx2 (1–19)
dengan:
p = tekanan pada dinding, dan
V = volume ruang.
Dalam tinjauan tiga dimensi (tinjauan ruang), kecepatan rata-rata gerak partikel merupakan resultan dari tiga komponen arah kecepatan menurut sumbu-x (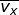 ), sumbu-y (
), sumbu-y ( 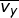 ), dan sumbu-z (
), dan sumbu-z ( 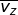 ), yang besarnya sama. Oleh karena itu, dapat dituliskan
), yang besarnya sama. Oleh karena itu, dapat dituliskan 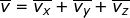 dengan
dengan 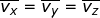 . Jika setiap komponen pada kedua ruas penamaan kecepatan tersebut dikuadratkan, dapat dituliskan :
. Jika setiap komponen pada kedua ruas penamaan kecepatan tersebut dikuadratkan, dapat dituliskan :
sehingga diperoleh,
Dengan demikian, Persamaan (1–19) dapat diubah menjadi :
atau
dengan:
N = banyaknya partikel gas,
m = massa 1 partikel gas,
v = kecepatan partikel gas, dan
V = volume gas.
Catatan Fisika :
Ukuran gelembung udara di dalam air berubah seiring dengan berubahnya kedalam gelembung tersebut di dalam air. Jika seorang penyelam scuba melepaskan gelembung udara di kedalaman air, tekanan air di kedalam tersebut menentukan besarnya volume gelembung udara. Saat gelembung udara tersebut naik ke permukaan, tekanan air menurun sehingga volume gelembung udara pun membesar. (Sumber: Contemporary College Physics, 1993)
Gelembung Udara
 |
| Penyelam. [3] |
2. Hubungan Antara Tekanan Gas dan Energi Kinetik
Pada Persamaan (1–20), Anda telah menyatakan hubungan antara besaran tekanan, volume, dan suhu (besaran makroskopis) suatu gas dengan besaran mikroskopis (massa, jumlah, dan kecepatan) partikel gas tersebut.
Dari pelajaran sebelumnya, Anda juga telah mempelajari bahwa setiap benda yang bergerak memiliki energi kinetik. Bagaimanakah hubungan antara ketiga variabel makroskopis gas (tekanan, volume, dan suhu) terhadap energi kinetiknya?
Perhatikanlah kembali Persamaan (1–18) dan Persamaan (1–21). Jika Persamaan (1–18) dituliskan menjadi:
p= NkT / V,
dan Persamaan (1–21) dituliskan sebagai
p = (1/3) (Nmv2 / V)
maka dapat diturunkan persamaan :
p= NKT / V = (1/3) (Nmv2 / V)
1/3 mv2 = kT (1–22)
Oleh karena EK = 1/2 mv2, maka Persamaan (1–22) dapat dituliskan menjadi :
2/3 (1/2 mv2) = kT
sehingga diperoleh,
2/3 EK = kT (1–23)
dan
EK = 2/3 kT (1–24)
Dari Persamaan (1–24) Anda dapat menyatakan bahwa energi kinetik gas berbanding lurus dengan temperaturnya. Jadi, jika temperatur gas naik, energi kinetiknya akan membesar. Demikian juga sebaliknya, jika suhu gas turun, energi kinetiknya akan mengecil.
Jika energi kinetik Persamaan (1–24) dituliskan sebagai EK = 3 (1/2 kT), besaran 1/2 kT disebut juga sebagai derajat kebebasan gas. Apakah derajat kebebasan gas itu? Derajat kebebasan berhubungan dengan kebebasan partikel gas untuk bergerak di dalam ruang. Jadi, jika energi kinetik suatu gas dinyatakan sebagai 3/2 kT, Anda dapat mengatakan bahwa gas tersebut memiliki 3 derajat kebebasan menurut sumbu-x, sumbu-y, dan sumbu-z. Derajat kebebasan ini berlaku untuk gas monoatomik, seperti Helium (He), Argon (Ar), dan Neon (Ne). Semakin tinggi suhu suatu gas, energi kinetiknya akan semakin besar. Secara fisis, meningkatnya energi kinetik gas tersebut berhubungan dengan meningkatnya jumlah derajat kebebasan yang dimilikinya. Pada gas-gas diatomik, seperti H2, N2, dan O2, energi kinetiknya pada suhu rendah adalah 3/2 kT, pada suhu sedang 5/2 kT, dan suhu tinggi 7/2 kT.
Derajat kebebasan gas-gas diatomik pada suhu rendah diperoleh dari kebebasan gerak partikel-partikelnya saat bertranslasi menurut sumbu-x, sumbu-y, dan sumbu-z (v2 = vx2 + vy2 + vz2 = 3vx2). Pada suhu sedang, partikelpartikel gas diatomik tersebut dapat bertranslasi dan berotasi. Namun, rotasi yang dialami partikel gas menurut sumbu-x diabaikan karena nilainya sangat kecil. Dengan demikian, energi kinetiknya, EK = 3/2 kT = 2 (1/2) kT = 5/2 kT. Jika temperatur gas diatomik tersebut dinaikkan lagi hingga mencapai ±1.000 K, gerak yang dilakukan oleh partikel-partikel gas adalah gerak translasi, rotasi, dan vibrasi (bergetar pada sumbunya). Energi kinetik gas pada suhu tinggi dinyatakan dengan :
EK = 3/2 kT + 2 (1/2) kT + 2 (1/2) kT + 7/2 kT
Anda telah mempelajari dari uraian di atas, bahwa jumlah derajat kebebasan partikel gas menentukan energi yang dimiliki atau disimpan oleh gas tersebut. Peninjauan energi partikel gas inilah yang dinamakan Prinsip Ekuipartisi Energi oleh James Clerk Maxwell.
3. Energi Dalam Gas Ideal
Energi kinetik sejumlah partikel gas yang terdapat di dalam suatu ruang tertutup disebut sebagai energi dalam gas (U). Jika di dalam ruangan tersebut terdapat N partikel gas, energi dalam gas dituliskan dengan persamaan :
U = NEK
Dengan demikian, energi dalam untuk gas monoatomik atau gas diatomik pada suhu rendah adalah :
U = NEK = 3/2 NkT
Adapun, energi dalam untuk gas-gas diatomik pada suhu sedang dinyatakan dengan :
U = 5/2 NkT
dan pada suhu tinggi, besar energi dalam gas adalah :
U = 7/2 NkT
4. Kecepatan Partikel Gas Ideal
Besaran lain yang dapat ditentukan melalui prinsip ekuipartisi energi gas adalah akar dari rata-rata kuadrat kelajuan (vrms = root mean square speed) gas, yang dirumuskan dengan :
Dari persamaan (1-24), Anda telah mengetahui bahwa EK = 3/2 kT. Dengan demikian dapat dirumuskan bahwa :
1/2 mv2 = 3/2 kT
v2 = 3kT / m
Berdasarkan persamaan gas ideal, Anda pun telah mengetahui bahwa pV = NkT. Jika hanya terdapat satu mol gas, persamaan gas ideal tersebut dapat dinyatakan pV = kT. Dengan demikian, Persamaan (1-25) dapat dituliskan menjadi :
Anda tentu masih ingat bahwa massa jenis ( ρ ) adalah perbandingan antara massa terhadap volume zat tersebut ( ρ = m / v) ). Oleh karena itu, Persamaan (1–26) dapat dituliskan menjadi :
Berdasarkan Persamaan (1–27) tersebut, Anda dapat menyatakan bahwa massa jenis gas berbanding terbalik dengan kelajuan partikelnya. Jadi, jika massa jenis ( ρ ) gas di dalam ruangan tertutup besar, kelajuan partikel gas tersebut akan semakin kecil.
Contoh Soal 5 :
Neon (Ne) adalah suatu gas monoatomik. Berapakah energi dalam 2 gram gas neon pada suhu 50°C jika massa molekul relatifnya Mr = 10 g/mol?
Kunci Jawaban :
Diketahui: m = 2 gram, T = 50°C, dan Mr = 10 g/mol.
U = 3/2 nRT = (3/2) (m/Mr) (RT)
U = 3/2 x (2 g/10 g/mol) x 8,31 J/molK x (50 273) K = 805,24 J.
Contoh Soal 6 :
Sebuah tangki bervolume 2,4 m3 diisi dengan 2 kg gas. Tekanan dalam tangki 1,3 atm. Berapakah kecepatan efektif molekul-molekul gas ini?
Kunci Jawaban :
Diketahui: V = 2,4 m3, m = 2 kg, dan p = 1,3 atm.
v = 687,52 m/s.
Rangkuman :
1. Gas Ideal adalah gas yang memenuhi sifat-sifat berpartikel banyak, antarpartikel tidak berinteraksi, arah gerak setiap partikel sembarang, ukuran partikel terhadap ruang tempatnya dapat diabaikan, tumbukan antarpartikel bersifat lenting sempurna, partikel gas terdistribusi merata di seluruh ruang, dan berlaku Hukum Newton tentang gerak.
2. Hukum Boyle berlaku pada proses isotermal
pV = konstan
p1V1 = p2V2
3. Hukum Gay-Lussac berlaku pada proses isobarik
V/T = Konstan atau V1/T1 = V2/T2
4. Hukum Charles berlaku pada proses isokhorik
p/T = Konstan atau p1/T1 = p2/T2
5. Hukum Boyle-Gay Lussac merupakan penggabungan antara Hukum Boyle dan Hukum Gay- Lussac
pV/T = Konstan atau p1V1/T1 = p2V2/T2
6. Persamaan keadaan gas ideal
pV = nRT atau pT = NkT
7. Tekanan gas ideal
p = 1/3 (Nmv2/V)
8. Energi dalam gas ideal
a. Gas monoatomik
EK = 3/2 NkT = 3/2 nRT
b. Gas diatomik
1) Pada suhu rendah:
U = NEK = 3/2 NkT = 3/2 nRT
2) Pada suhu sedang:
U = NEK = 5/2 NkT = 5/2 nRT
3) Pada suhu tinggi:
U = NEK = 7/2 NkT = 7/2 nRT
Anda sekarang sudah mengetahui Teori Kinetik Gas dan Persamaan Gas Ideal. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Saripudin, A., D. Rustiawan K., dan A. Suganda. 2009. Praktis Belajar Fisika 1 : untuk Kelas XI Sekolah Menengah Atas / Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan Departemen Nasional, Departemen Pendidikan Nasional, Jakarta. p. 234.
Referensi Lainnya :
Jones, E.R. dan Chiulders, R.L. 1994. Contemporary College Physics, Second Edition. New York: Addison Wesley Longman.
Referensi :
Saripudin, A., D. Rustiawan K., dan A. Suganda. 2009. Praktis Belajar Fisika 1 : untuk Kelas XI Sekolah Menengah Atas / Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan Departemen Nasional, Departemen Pendidikan Nasional, Jakarta. p. 234.
Referensi Lainnya :
Jones, E.R. dan Chiulders, R.L. 1994. Contemporary College Physics, Second Edition. New York: Addison Wesley Longman.














0 komentar:
Posting Komentar