Diagram fase adalah sejenis grafik yang
digunakan untuk menunjukkan kondisi kesetimbangan antara fase-fase yang berbeda
dari suatu zat yang sama, melibatkan 3 komponen, yaitu Tekanan (P), Volume (V) dan
Temperatur (T). Diagram Fasa yang melibatkan 3 komponen berupa grafik 3
dimensi, sedangkan Diagram Fasa yang hanya melibatkan 2 komponen berupa Grafik
2 dimensi.
Diagram P-T untuk zat murni secara umum
dapat dilihat dalam gambar berikut ini. Diagram ini sering juga disebut dengandiagram fasa zat karena menunjukkan
ketiga jenis fasa zat yang dipisahkan oleh garis
- Garis Sublimation line (garis sublim) memisahkan daerah uap (vapor) dengan daerah beku (solid).
- — Garis vaporization line (garis penguapan) memisahkan daerah cair dari daerah uap. Garis melting line (garis leleh) memisahkan daerah beku dari daerah cair.
- — Pada gambar diatas, terlihat dua lokasi untuk garis melting line yang dibedakan dengan jenis garis. Garis putus-putus melting line merupakan garis melting line untuk zat yang memuai saat beku, sementara untuk zat yang menyusut saat beku garis melting line nya berupa garis biasa.
- Dari gambar diatas juga terlihat bahwa kondisi liquid (cair) hanya dapat terjadi pada tekanan dibawah tekanan triple point.
Dalam kimia fisik, mineralogi,
dan teknik material diagram fase adalah sejenis grafikyang
digunakan untuk menunjukkan kondisi kesetimbangan antara fase-fase yang
berbeda dari suatu zat yang sama. Dalam matematika dan fisika, diagram fase
juga mempunyai arti sinonim dengan ruang
fase.
Komponen-komponen diagram fase adalah garis kesetimbangan atau sempadan fase, yang merujuk pada
garis yang menandakan terjadinya transisi fase.
Likuidusa dalah
temperatur di mana zat tersebut stabil dalam keadaan cair.
Titik Tripel
Titik tripel adalah
titik potong dari garis-garis kesetimbangan antara tiga fase benda, biasanya padat, cair,
dan gas.
Pada titik ini semua fasa berada dalam
kesetimbangan, temperatur dan tekanan tetap.
Titik tripel untuk air ada pada temperatur
0,01 oC dan tekanan 4,58 mmHg. Titik tripel untuk air, 273,16 K.
Derajat kebebasan: F= c – p + 2
(c = jumlah minimum komponen yang
menentukan sistem; p= jumlah fasa; 2= variabel yang menentukan sistem);
menyatakan seberapa banyak faktor yang menyatakan suatu sistem.
Derajat kebebasan untuk air pada titik
tripel adalah: f= 1-3+2=0, karena c=1 yaitu air, p=3 yaitu es, air dan uap air.
Diagram fase 2D
Diagram
fase yang paling sederhana adalah diagram tekanan-temperatur dari zat tunggal,
seperti air. Sumbu-sumbu
diagram berkoresponden
dengan tekanan dantemperatur.
Diagram fase pada ruang tekanan-temperatur menunjukkan garis kesetimbangan atau
sempadan fase antara tiga fase padat, cair,
dan gas.
Diagram
fase yang umum, Garis titik-titik merupakan sifat anomali air.Garis berwarna
hijau menandakan titik beku dan
garis biru menandakan titik didih yang
berubah-ubah sesuai dengan tekanan.
Penandaan diagram fase menunjukkan
titik-titik di mana energi bebas bersifat non-analitis. Fase-fase dipisahkan
dengan sebuah garis non-analisitas, di manatransisi
fase terjadi, dan disebut sebagaisempadan fase.
Pada diagaram sebelah kiri, sempadan fase
antara cair dan gas tidak berlanjut sampai tak terhingga.Ia akan berhenti pada
sebuah titik pada diagaram fase yang disebut sebagai titik kritis.
Ini menunjukkan bahwa pada temperatur dan tekanan yang sangat tinggi, fase cair
dan gas menjadi tidak dapat dibedakan[1],
yang dikenal sebagai fluida
superkritis. Pada air, titik kritis ada pada sekitar 647
K dan 22,064 MPa (3.200,1 psi)
Keberadaan titik kritis cair-gas menunjukkan
ambiguitas pada definisi di atas. Ketika dari cair menjadi gas, biasanya akan
melewati sebuah sempadan fase, namun adalah mungkin untuk memilih lajur yang
tidak melewati sempadan dengan berjalan menuju fase superkritis. Oleh karena
itu, fase cair dan gas dapat dicampur terus menerus.
Sempadan padat-cair pada diagram fase
kebanyakan zat memiliki gradien yang
positif. Hal ini dikarenakan fase padat memiliki densitas yang
lebih tinggi daripada fase cair, sehingga peningkatan tekanan akan
meningkatkan titik leleh.
Pada beberapa bagian diagram fase air, sempadan fase padat-cair air memiliki
gradien yang negatif, menunjukkan bahwa es mempunyai densitas yang lebih kecil
daripada air.
Pada grafik dua dimensi, dua
kuantitas termodinamika dapat ditunjukkan pada sumbu horizontal dan vertikal.
Kuantitas termodinamika lainnya dapat diilustrasikan dengan bertumpuk sebagai
sebuah deret garis atau kurva. Garis-garis ini mewakili kuantitas termodinamika
pada nilai konstan tertentu.
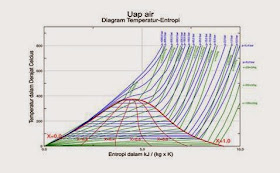
Diagram
fase temperatur dan entropi jenis untuk air/uap.Pada area di bawah kubah, air
dan uap berada dalam keadaan kesetimbangan. Titik kritisnya ada
di atas kubah.Garis/kurva biru adalahisobar yang
menunjukkan tekanan konstan.Garis/kurva hijau adalah isokor yang menunjukkan volume
jenis konstan. Garis merah menunjukkan kualitas konstan
Diagram fase 3D
Adalah mungkin untuk
membuat grafik tiga dimensi (3D) yang menunjukkan tiga kuantitas
termodinamika.Sebagai contoh, untuk sebuah komponen tunggal, koordinat 3D
Cartesius dapat menunjukkan temperatur (T), tekanan (P), dan volume jenis (v).
Grafik 3D tersebut kadang-kadang disebut diagram P-v-T. Kondisi kesetimbangan
akan ditungjukkan sebagai permukaan tiga dimensi dengan luas permukaan untuk
fase padat, cair, dan gas. Garis pada permukaan tersebut disebut garis tripel, di mana zat padat, cair,
dan gas dapat berada dalam kesetimbangan.Titik kritis masih berupa sebuah titik
pada permukaan bahkan pada diagram fase 3D. Proyeksi ortografi grafik
P-v-T 3D yang menunjukkan tekanan dan temperatur sebagai sumbu vertikal dan
horizontal akan menurunkan plot 3D tersebut menjadi diagram tekanan-temperatur
2D. Ketika hal ini terjadi, permukaan padat-uap, padat-cair, dan cair-uap akan
menjadi tiga kurva garis yang akan bertemu pada titik tripel, yang merupakan
proyeksi ortografik garis tripel.



Tidak ada komentar:
Posting Komentar