Keadaan suatu sistem dalam termodinamika dapat berubah-ubah, berdasarkan percobaan besaran-besaran keadaan sistem tersebut. Namun, besaran-besaran keadaan tersebut hanya berarti jika sistem berada dalam keadaan setimbang. Misalnya, jika Anda mengamati suatu gas yang sedang memuai di dalam tabung, temperatur dan tekanan gas tersebut di setiap bagian tabung dapat berubah-ubah. Oleh karena itu, Anda tidak dapat menentukan suhu dan temperatur gas saat kedua besaran tersebut masih berubah. Agar dapat menentukan besaran-besaran keadaan gas, gas harus dalam keadaan reversibel. Apakah yang dimaksud dengan proses reversibel?
Proses reversibel adalah suatu proses dalam sistem di mana sistem hampir selalu berada dalam keadaan setimbang.
Perhatikanlah Gambar 8.
|
Gambar 8. Perubahan keadaan gas dalam siklus
reversibel.
|
Dari grafik
p–V tersebut, suatu gas mengalami perubahan keadaan dari A ke B. Diketahui
bahwa pada keadaan A sistem memiliki tekanan p1 dan
volume V1. Pada tekanan B, tekanan sistem berubah
menjadi p2 dan volumenya menjadi V2. Jika
gas tersebut mengalami proses reversibel, keadaan gas tersebut dapat dibalikkan
dari keadaan B ke A dan tidak ada energi yang terbuang. Oleh karena itu, pada
proses reversibel, kurva p–V yang dibentuk oleh perubahan keadaan sistem dari A
ke B dan dari B ke A adalah sama.
Dalam kenyataannya, sulit untuk menemukan proses reversibel karena proses ini tidak memperhitungkan energi yang hilang dari dalam sistem (misalnya, gesekan). Namun, proses reversibel memenuhi Hukum Pertama Termodinamika. Tahukah Anda yang dimaksud dengan siklus termodinamika? Siklus termodinamika adalah proses yang terjadi pada sistem sehingga akhirnya sistem kembali pada keadaan awalnya.
Prinsip siklus termodinamika ini kali pertama dijelaskan oleh seorang insinyur Perancis bernama Sadi Carnot dan disebut siklus Carnot. Siklus Carnot adalah suatu siklus ideal reversibel yang terdiri atas dua proses isotermal dan proses adiabatik, seperti terlihat pada Gambar 9.
|
Gambar 9. Siklus Carnot.
|
Siklus
Carnot ini merupakan salah satu prinsip dasar siklus termodinamika yang
digunakan untuk memahami cara kerja mesin Carnot. Perhatikanlah Gambar 10.
berikut.
|
Gambar 10. Siklus Carnot pada mesin Carnot.
|
Pada gambar
tersebut suatu gas ideal berada di dalam silinder yang terbuat dari bahan yang
tidak mudah menghantarkan panas. Volume silinder tersebut dapat diubah dengan
cara memindahkan posisi pistonnya. Untuk mengubah tekanan gas, diletakkan
beberapa beban di atas piston. Pada sistem gas ini terdapat dua sumber kalor
yang disebut reservoir suhu tinggi (memiliki suhu 300 K) gas memiliki
temperatur tinggi (300 K), tekanan tinggi (4 atm), dan volume rendah (4 m3).
Berikut urutan keempat langkah proses yang terjadi dalam siklus Carnot.
a. Pada langkah, gas mengalami ekspansi isotermal. Reservoir suhu tinggi menyentuh dasar silinder dan jumlah beban di atas piston dikurangi. Selama proses ini berlangsung, temperatur sistem tidak berubah, namun volume sistem bertambah. Dari keadaan 1 ke keadaan 2, sejumlah kalor (Q1) dipindahkan dari reservoir suhu tinggi ke dalam gas.
b. Pada
langkah kedua, gas berubah dari keadaan 2 ke keadaan 3 dan mengalami proses
ekspansi adiabatik. Selama proses ini berlangsung, tidak ada kalor yang keluar
atau masuk ke dalam sistem. Tekanan gas diturunkan dengan cara mengurangi beban
yang ada di atas piston. Akibatnya, temperatur sistem akan turun dan volumenya
bertambah.
c. Pada
langkah ketiga, keadaan gas berubah dari keadaan 3 ke keadaan 4 melalui proses
kompresi isotermal. Pada langkah ini, reservoir suhu rendah (200 K) menyentuh
dasar silinder dan jumlah beban di atas piston bertambah. Akibatnya tekanan
sistem meningkat, temperaturnya konstan, dan volume sistem menurun. Dari
keadaan 3 ke keadaan 4, sejumlah kalor (Q2) dipindahkan dari gas ke
reservoir suhu rendah untuk menjaga temperatur sistem agar tidak berubah.
d. Pada
langkah keempat, gas mengalami proses kompresi adiabatik dan keadaannya berubah
dari keadaan 4 ke keadaan1. Jumlah beban di atas piston bertambah. Selama
proses ini berlangsung, tidak ada kalor yang keluar atau masuk ke dalam sistem,
tekanan sistem meningkat, dan volumenya berkurang.
Menurut kurva hubungan p–V dari siklus Carnot, usaha yang dilakukan oleh gas adalah luas daerah di dalam kurva p–V siklus tersebut. Oleh karena siklus selalu kembali ke keadaannya semula, ΔUsiklus = 0 sehingga persamaan usaha siklus (Wsiklus) dapat dituliskan menjadi
Wsiklus = ΔQsiklus = (Q1 – Q2) (1–28)
dengan:
Q1 = kalor yang diserap sistem, dan
Q2 = kalor yang dilepaskan
sistem.
Ketika mesin mengubah energi kalor menjadi energi mekanik (usaha). Perbandingan antara besar usaha yang dilakukan sistem (W) terhadap energi kalor yang diserapnya (Q1) disebut sebagai efisiensi mesin. Persamaan matematis efisiensi mesin ini dituliskan dengan persamaan :
η = (W/Q1) x
100 %
(1–29)
dengan η =
efisiensi mesin.
Oleh karena
usaha dalam suatu siklus termodinamika dinyatakan dengan
W = Q1 – Q2
maka Persamaan (1–30) dapat dituliskan menjadi :
η = (Q1 - Q2
/ Q1) x 100 %
Pada mesin
Carnot, besarnya kalor yang diserap oleh sistem (Q1) sama
dengan temperatur reservoir suhu tingginya (T1). Demikian juga, besarnya kalor
yang dilepaskan sistem (Q2) sama dengan temperatur reservoir
suhu rendah mesin Carnot tersebut. Oleh karena itu, Persamaan (1–30) dapat
dituliskan menjadi :
Dari Persamaan (1–31) tersebut, Anda dapat menyimpulkan bahwa efisiensi mesin Carnot dapat ditingkatkan dengan cara menaikkan temperatur reservoir suhu tinggi atau menurunkan temperatur reservoir suhu rendah.
Catatan
Fisika :
Lokomotif Uap
|
Lokomotif Uap. [6]
|
Lokomotif
uap ini bekerja dengan menggunakan hukum pertama termodinamika. Saat panas
dihasilkan oleh batubara atau kayu yang dibakar dalam mesin lokomotif, sebagian
energi menaikkan suhu air (yang mendidih dan menghasilkan uap) dalam mesin.
Sisa energi dipakai guna mengekspansikan uap untuk menghasilkan kerja dan
menggerakkan lokomotif. (Sumber: Fisika Universitas, 1998)
Contoh Soal
11 :
Sebuah mesin
gas ideal bekerja dalam suatu siklus Carnot antara suhu tinggi T1 °C dan dan suhu rendah 127 °C. Jika mesin
menyerap kalor 60 kkal pada suhu tertinggi dan membuang kalor 48 kkal,
hitunglah:
a. usaha yang dihasilkan dalam satu siklus,
b. efisiensi
mesin tersebut, dan
c. besarnya
suhu tinggi T1.
Kunci Jawaban :
Diketahui: T2 = 127 °C, Q1 = 60 kkal, dan Q2 = 48 kkal.
a. Berdasarkan Hukum Pertama termodinamika:
W = Q1 – Q2 = 60 kkal – 48 kkal = 12 kkal
b. Efisiensi mesin Carnot
η = (W/Q1) x
100 % = (12 kkal / 60 kkal) x 100 % = 20%
c. Efisiensi
mesin dalam bentuk suhu dinyatakan dengan persamaan :
Contoh Soal
12 :
Sebuah mesin
Carnot yang menggunakan reservoir suhu tinggi bersuhu 800 K memiliki efisiensi
40%. Agar efisiensi maksimumnya naik menjadi 50%, tentukanlah kenaikan suhu
yang harus dilakukan pada reservoir suhu tinggi.
Kunci
Jawaban :
Diketahui: T1 = 800 K, η1 = 40%, dan η2 = 50%.
Cara umum
• Efisiensi mesin semula η1 = 40%
• Agar
efisiensi menjadi η2 = 50% untuk T2 = 480 K
Jadi,
temperatur suhu tinggi harus dinaikkan menjadi 960 K.
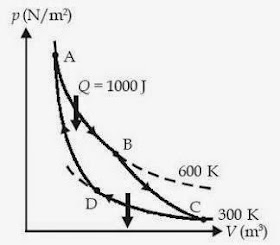
Contoh Soal
13 :
Suatu mesin
Carnot bekerja di antara suhu 600 K dan 300 K serta menerima kalor sebesar
1.000 joule (seperti terlihat pada gambar). Usaha yang dilakukan mesin dalam
satu siklus adalah ....
a. 300 J
b. 400 J
c. 500 J
d. 600 J
e. 700 J
Kunci
Jawaban :
W = 500
joule
Jawab: c




Tidak ada komentar:
Posting Komentar